در مبارزه پیچیده و دشوار با سرطان، همواره نیاز به روشهای درمانی نوآورانه و مؤثرتر احساس میشود. زمانی که گزینههای درمانی سنتی با محدودیتهایی مواجه میشوند، یا برای به حداقل رساندن عوارض جانبی سیستمیک داروهای شیمیدرمانی، پزشکان به تکنیکهای پیشرفتهتری روی میآورند. در این میان، کموامبولیزاسیون (Chemoembolization) به عنوان یک روش درمانی منطقهای و هدفمند، انقلابی در مدیریت برخی از سرطانها، به ویژه سرطان کبد، ایجاد کرده است. این روش نه تنها به طور مستقیم بر سلولهای سرطانی متمرکز میشود، بلکه عوارض جانبی را به حداقل میرساند و کیفیت زندگی بیمار را بهبود میبخشد.
تصور کنید داروی شیمیدرمانی، به جای پخش شدن در کل بدن و تأثیر بر سلولهای سالم، به طور مستقیم به تومور تزریق شود و همزمان، مسیر تغذیه آن نیز قطع گردد. این دقیقا همان چیزی است که کموامبولیزاسیون با دقت و ظرافت بالا انجام میدهد. این تکنیک نوین در رادیولوژی مداخلهای، با ترکیب دو رویکرد قدرتمند – “شیمیدرمانی” برای از بین بردن سلولهای سرطانی و “آمبولیزاسیون” برای قطع جریان خون به تومور – راهکاری منحصر به فرد برای کنترل رشد تومور و کاهش اندازه آن ارائه میدهد. این ویژگی، کموامبولیزاسیون را به ابزاری کلیدی در درمان سرطانهای پیچیده تبدیل کرده است.
فهرست محتوا
هدف این مقاله، ارائه یک راهنمای جامع و اختصاصی درباره کموامبولیزاسیون است؛ راهنمایی که تمامی جنبههای این روش درمانی حیاتی را از چیستی و کاربردهای آن گرفته تا آمادگیهای لازم، نحوه انجام، مزایا، و عوارض جانبی احتمالی، با زبانی ساده و در عین حال دقیق توضیح میدهد. محتوای این مقاله با دقت فراوان گردآوری شده و کاملاً انحصاری است، به گونهای که اطمینان داریم مشابه آن را در هیچ جای دیگری از فضای اینترنت نخواهید یافت. ما به شما کمک میکنیم تا با درک عمیق از اهمیت و جزئیات کموامبولیزاسیون، با اطمینان خاطر بیشتری گام در مسیر تشخیص و درمان بیماریهای سرطانی بگذارید.
کموامبولیزاسیون چیست؟
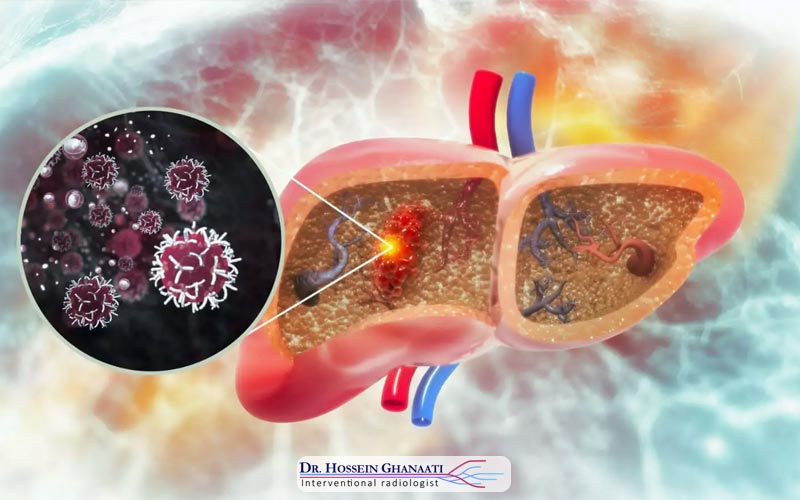
کموامبولیزاسیون، که به عنوان شیمیدرمانی آمبولیک نیز شناخته میشود، یک روش درمانی پیشرفته و با حداقل تهاجم است که در رادیولوژی مداخلهای برای درمان برخی از انواع سرطانها، به ویژه سرطان کبد، مورد استفاده قرار میگیرد. این تکنیک، با هدف رساندن دوزهای بالای داروهای شیمیدرمانی به طور مستقیم به تومور، و در عین حال قطع جریان خون تغذیهکننده آن، به سلولهای سرطانی حمله میکند. واژه “کمو” به شیمیدرمانی و “آمبولیزاسیون” به فرآیند مسدود کردن رگهای خونی اشاره دارد، که در کنار هم یک رویکرد دوگانه و قدرتمند را تشکیل میدهند.
در طول فرآیند کموامبولیزاسیون، یک کاتتر بسیار ظریف از طریق یک برش کوچک در کشاله ران (شریان فمورال) وارد شریان اصلی بدن شده و با دقت و تحت هدایت تصویربرداری (مانند فلوروسکوپی یا آنژیوگرافی)، به سمت شریانی که تومور را تغذیه میکند، هدایت میشود. پس از رسیدن کاتتر به محل دقیق، ترکیبی از داروهای شیمیدرمانی با ذرات آمبولیک کوچک (که میتوانند ژلفوم، میکروکرهها یا ذرات دیگر باشند) از طریق کاتتر تزریق میشود. این ذرات آمبولیک، رگهای خونی تغذیهکننده تومور را مسدود میکنند و باعث میشوند داروهای شیمیدرمانی برای مدت زمان طولانیتری در داخل تومور باقی بمانند.

مزیت اصلی کموامبولیزاسیون این است که داروهای شیمیدرمانی به طور مستقیم به تومور تحویل داده میشوند، در حالی که قرار گرفتن بافتهای سالم در معرض دارو به حداقل میرسد. این امر به پزشکان اجازه میدهد تا دوزهای بالاتری از دارو را به تومور برسانند و در عین حال، عوارض جانبی سیستمیک که اغلب با شیمیدرمانی وریدی همراه هستند (مانند تهوع، ریزش مو، خستگی شدید)، به طور قابل توجهی کاهش یابد. این رویکرد هدفمند، نه تنها کارایی درمان را افزایش میدهد، بلکه کیفیت زندگی بیمار را نیز بهبود میبخشد.
اثر ترکیبی داروهای شیمیدرمانی و مسدود کردن رگهای خونی تغذیهکننده تومور، منجر به تخریب سلولهای سرطانی میشود. قطع جریان خون (ایسکمی) تومور را از اکسیژن و مواد مغذی محروم میکند، در حالی که داروهای شیمیدرمانی به طور مستقیم به سلولهای سرطانی حمله میکنند. این دو مکانیسم در کنار هم، کموامبولیزاسیون را به یک استراتژی درمانی مؤثر برای کنترل رشد تومور، کاهش اندازه آن و در برخی موارد، حتی آمادهسازی بیمار برای جراحی یا پیوند کبد تبدیل کرده است.
انواع کموامبولیزاسیون و تفاوتهای آنها
کموامبولیزاسیون به دو روش اصلی تقسیم میشود که هر یک دارای ویژگیها و کاربردهای خاص خود هستند: کموامبولیزاسیون شریانی ترانس کبد (TACE) و کموامبولیزاسیون با ذرات بارگذاری شده با دارو (DEB-TACE یا TACE با DEB). TACE سنتی، رایجترین نوع کموامبولیزاسیون است که در آن داروهای شیمیدرمانی به صورت مایع یا امولسیون با یک عامل آمبولیک (مانند ژلفوم یا لیپیودول) مخلوط میشوند و از طریق شریان تغذیهکننده به تومور کبد تزریق میگردند. لیپیودول، یک روغن یددار است که به عنوان حامل دارو عمل کرده و به ماندگاری بیشتر دارو در تومور کمک میکند.
DEB-TACE یا کموامبولیزاسیون با ذرات بارگذاری شده با دارو، یک پیشرفت مهم در این زمینه است. در این روش، داروهای شیمیدرمانی (معمولاً دوکسوروبیسین) به طور مستقیم در میکروکرههای کوچکی (ذرات کروی شکل با اندازه مشخص) بارگذاری میشوند. این میکروکرهها سپس از طریق کاتتر به شریان تغذیهکننده تومور تزریق میشوند. مزیت اصلی DEB-TACE این است که دارو به تدریج و به صورت کنترل شده از میکروکرهها آزاد میشود و به مدت زمان طولانیتری در داخل تومور با غلظت بالا باقی میماند، در حالی که انتشار سیستمیک آن به حداقل میرسد. این امر به کاهش عوارض جانبی و افزایش اثربخشی درمان کمک میکند.
تفاوت عمده بین این دو روش در نحوه تحویل دارو و مدت زمان آزاد شدن آن است. در TACE سنتی، دارو سریعتر آزاد میشود و ممکن است بخشی از آن وارد جریان خون سیستمیک شود. اما در DEB-TACE، دارو به طور تدریجی و هدفمندتر آزاد میشود، که این ویژگی باعث میشود غلظت دارو در تومور برای مدت طولانیتری بالا بماند و عوارض جانبی سیستمیک کمتر باشد. این ویژگی برای بیماران با عملکرد کبدی ضعیف، یا کسانی که به شیمیدرمانی سیستمیک حساسیت دارند، میتواند بسیار مهم باشد.
انتخاب بین TACE سنتی و DEB-TACE در کموامبولیزاسیون بستگی به عوامل متعددی دارد، از جمله نوع و اندازه تومور، وضعیت عمومی بیمار، عملکرد کبد، و نظر پزشک معالج. در برخی موارد، پزشکان ممکن است ترکیبی از این روشها یا سایر درمانها را برای دستیابی به بهترین نتایج درمانی توصیه کنند. هر دو روش، گامهای مهمی در درمانهای منطقهای سرطان کبد به شمار میروند و گزینههای مؤثری برای مدیریت بیماریهای سرطانی هستند.
کاربردهای اصلی کموامبولیزاسیون در درمان سرطان
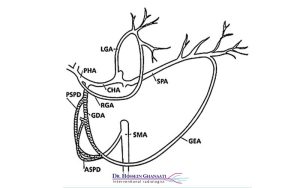
کموامبولیزاسیون به طور عمده در درمان سرطانهایی که در کبد اولیه هستند (مانند کارسینوم هپاتوسلولار یا HCC) یا سرطانهایی که از سایر نقاط بدن به کبد متاستاز دادهاند (مانند متاستازهای کولورکتال)، کاربرد فراوان دارد. کبد یک اندام منحصر به فرد است زیرا تومورها در آن عمدتاً از طریق شریان کبدی تغذیه میشوند، در حالی که بافت سالم کبد، خون خود را عمدتاً از ورید باب دریافت میکند. این ویژگی آناتومیک، کموامبولیزاسیون را به یک روش بسیار مؤثر برای درمان تومورهای کبدی تبدیل میکند، زیرا میتوان جریان خون شریانی تومور را هدف قرار داد بدون اینکه به بافت سالم کبد آسیب جدی وارد شود.
یکی از اصلیترین کاربردهای کموامبولیزاسیون، درمان کارسینوم هپاتوسلولار (HCC)، شایعترین نوع سرطان کبد است. در بیمارانی که کاندید جراحی یا پیوند کبد نیستند (به دلیل اندازه یا تعداد تومورها، یا وضعیت سلامت عمومی)، کموامبولیزاسیون میتواند به عنوان یک درمان اولیه یا به عنوان پلی برای رساندن بیمار به مرحلهای که کاندید جراحی شود، استفاده شود. این روش میتواند رشد تومور را کنترل کرده، اندازه آن را کاهش دهد، و بقای بیمار را افزایش دهد.
کموامبولیزاسیون همچنین در درمان متاستازهای کبدی از سرطانهای دیگر، به ویژه متاستازهای ناشی از سرطان کولورکتال، کاربرد دارد. گرچه برای این نوع سرطانها معمولاً شیمیدرمانی سیستمیک خط اول درمان است، اما در مواردی که بیماری به درمان سیستمیک پاسخ نمیدهد یا برای کاهش حجم تومور قبل از جراحی، کموامبولیزاسیون میتواند یک گزینه مؤثر باشد. این روش به خصوص زمانی که متاستازها به سایر نقاط بدن گسترش نیافته باشند، کارآمد است.
علاوه بر این، کموامبولیزاسیون میتواند به عنوان یک درمان تسکینی برای کاهش علائم ناشی از تومورهای بزرگ کبدی (مانند درد یا زردی) استفاده شود. در برخی موارد، ممکن است کموامبولیزاسیون با سایر روشهای درمانی سرطان، مانند ابلیشن رادیوفرکانسی (RFA)، پرتودرمانی، یا شیمیدرمانی سیستمیک، ترکیب شود تا نتایج درمانی بهتری حاصل شود. تصمیمگیری در مورد استفاده از کموامبولیزاسیون و ترکیب آن با سایر درمانها، توسط یک تیم چند رشتهای از پزشکان (شامل انکولوژیست، رادیولوژیست مداخلهای و جراح) و بر اساس وضعیت خاص هر بیمار انجام میشود.
آمادگیهای لازم قبل از انجام کموامبولیزاسیون
آمادگیهای لازم قبل از انجام کموامبولیزاسیون برای اطمینان از ایمنی بیمار و موفقیت فرآیند درمانی بسیار حیاتی هستند. اولین گام، ارزیابی جامع پزشکی است. پزشک معالج، به ویژه رادیولوژیست مداخلهای، سابقه پزشکی بیمار را به دقت بررسی میکند، شامل هرگونه بیماری زمینهای (به ویژه مشکلات کلیوی، قلبی، یا تنفسی)، حساسیتها (به ویژه به داروهای کنتراستزا یا بیحسی)، و داروهای مصرفی (به خصوص داروهای رقیقکننده خون). ممکن است نیاز باشد مصرف برخی داروها قبل از عمل متوقف شود.
دومین مرحله شامل انجام آزمایشات و تصویربرداریهای لازم است. این آزمایشات معمولاً شامل آزمایش خون (برای بررسی عملکرد کلیه و کبد، شمارش سلولهای خونی، و توانایی انعقاد خون) و تصویربرداریهای بهروز از کبد (مانند سی تی اسکن، ام آر آی یا سونوگرافی) است. این تصویربرداریها به پزشک کمک میکند تا اندازه و موقعیت دقیق تومورها را مشخص کند و شریانهای تغذیهکننده آنها را شناسایی کند، که برای برنامهریزی دقیق فرآیند کموامبولیزاسیون ضروری است.
بحث و مشورت کامل با بیمار نیز از اهمیت بالایی برخوردار است. پزشک باید فرآیند کموامبولیزاسیون، مزایا، خطرات احتمالی، و عوارض جانبی مورد انتظار را به طور کامل برای بیمار توضیح دهد. بیمار باید فرصت داشته باشد تا سوالات خود را بپرسد و رضایت آگاهانه خود را برای انجام این روش درمانی اعلام کند. این گفتگو به کاهش اضطراب بیمار و اطمینان از همکاری او در طول فرآیند کمک میکند.
در روز عمل کموامبولیزاسیون، معمولاً به بیمار توصیه میشود که از چند ساعت قبل از آزمایش ناشتا باشد. ممکن است به بیمار داروهای آرامبخش خفیف داده شود تا در طول فرآیند احساس آرامش بیشتری داشته باشد. در برخی موارد، برای بیمارانی که نمیتوانند برای مدت طولانی بیحرکت بمانند یا بسیار مضطرب هستند، ممکن است بیهوشی عمومی یا آرامبخشی عمیق در نظر گرفته شود. رعایت تمامی این آمادگیها، به تیم پزشکی کمک میکند تا کموامبولیزاسیون را با بالاترین سطح ایمنی و کارایی انجام دهند.
نحوه انجام کموامبولیزاسیون و مراحل آن
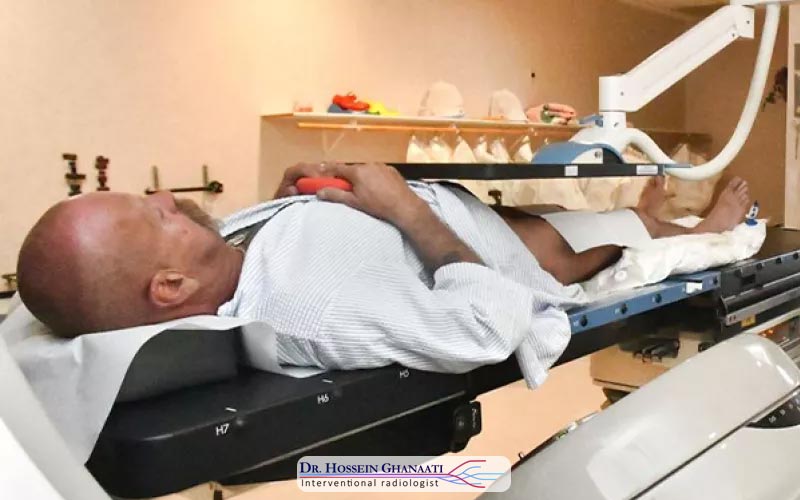
کموامبولیزاسیون یک فرآیند پیچیده و دقیق است که توسط یک رادیولوژیست مداخلهای و تیم پزشکی مجرب در اتاق عمل استریل انجام میشود. مراحل اصلی این روش به شرح زیر است: ابتدا، بیمار روی تخت تصویربرداری دراز میکشد و تحت مانیتورینگ علائم حیاتی (ضربان قلب، فشار خون، سطح اکسیژن) قرار میگیرد. ناحیه کشاله ران (معمولاً شریان فمورال) که محل ورود کاتتر است، با مواد ضدعفونیکننده تمیز شده و سپس با بیحسی موضعی بیحس میشود. این کار باعث میشود بیمار در طول ورود کاتتر دردی احساس نکند.
پس از بیحسی، یک برش کوچک (حدود چند میلیمتر) در کشاله ران ایجاد میشود و یک سوزن و سپس یک غلاف (Sheath) وارد شریان فمورال میشود. سپس، یک سیم راهنما و کاتتر بسیار ظریف از طریق این غلاف وارد شریان میشوند و تحت هدایت فلوروسکوپی (یک نوع تصویربرداری اشعه ایکس زنده)، به سمت شریانهای تغذیهکننده تومور در کبد هدایت میشوند. در طول این فرآیند، ممکن است ماده کنتراستزا تزریق شود تا رگهای خونی و تومورها به وضوح در تصاویر فلوروسکوپی قابل مشاهده باشند و رادیولوژیست بتواند مسیر دقیق کاتتر را دنبال کند.
پس از رسیدن کاتتر به محل صحیح (شریان تغذیهکننده تومور)، ترکیبی از داروهای شیمیدرمانی و ذرات آمبولیک (که میتواند شامل ژلفوم، میکروکرههای بارگذاری شده با دارو، یا سایر ذرات مسدودکننده باشد) از طریق کاتتر تزریق میشود. داروهای شیمیدرمانی به طور مستقیم به تومور تحویل داده میشوند، در حالی که ذرات آمبولیک، رگهای خونی تغذیهکننده تومور را مسدود میکنند. این مسدودسازی، باعث میشود دارو برای مدت طولانیتری در داخل تومور باقی بماند و همچنین، تومور را از اکسیژن و مواد مغذی محروم میسازد.
پس از اتمام تزریق، کاتتر و غلاف به آرامی از بدن خارج میشوند و برای جلوگیری از خونریزی، محل ورود با فشار دستی، بانداژ فشاری، یا وسایل بستن شریان بسته میشود. کل فرآیند کموامبولیزاسیون معمولاً بین 1 تا 3 ساعت طول میکشد. پس از عمل، بیمار برای چند ساعت تحت نظر قرار میگیرد تا از پایداری وضعیت او اطمینان حاصل شود و سپس میتواند با دستورالعملهای لازم برای مراقبت در منزل، مرخص شود.
مزایای کموامبولیزاسیون نسبت به شیمیدرمانی سیستمیک
کموامبولیزاسیون مزایای قابل توجهی نسبت به شیمیدرمانی سیستمیک (وریدی) دارد، به خصوص در درمان سرطان کبد. یکی از اصلیترین مزایا، هدفمند بودن و غلظت بالای دارو در تومور است. در شیمیدرمانی سیستمیک، دارو در سراسر بدن پخش میشود و تنها بخش کوچکی از آن به تومور میرسد. اما در کموامبولیزاسیون، دارو مستقیماً به شریان تغذیهکننده تومور تزریق میشود، که این امر منجر به غلظت بسیار بالای دارو در تومور و افزایش اثربخشی آن میشود، در حالی که قرار گرفتن بافتهای سالم در معرض دارو به حداقل میرسد.
مزیت دیگر، کاهش چشمگیر عوارض جانبی سیستمیک است. از آنجایی که داروهای شیمیدرمانی به طور موضعی عمل میکنند و انتشار آنها به جریان خون عمومی محدود است، بیمار عوارض جانبی کمتری مانند تهوع و استفراغ شدید، ریزش مو، خستگی مزمن، و تضعیف سیستم ایمنی را تجربه میکند. این موضوع به طور قابل توجهی کیفیت زندگی بیمار را در طول دوره درمان بهبود میبخشد و به او امکان میدهد تا فعالیتهای روزمره خود را با ناراحتی کمتری ادامه دهد.
کموامبولیزاسیون همچنین به دلیل قطع همزمان جریان خون تومور، یک مکانیسم درمانی دوگانه را ارائه میدهد. ذرات آمبولیک، رگهای خونی تغذیهکننده تومور را مسدود میکنند و تومور را از اکسیژن و مواد مغذی محروم میسازند، در حالی که داروهای شیمیدرمانی به سلولهای سرطانی حمله میکنند. این دو مکانیسم در کنار هم، اثربخشی درمان را افزایش میدهند و میتوانند منجر به کنترل بهتر رشد تومور یا حتی کوچک شدن آن شوند.
این روش درمانی با حداقل تهاجم، معمولاً نیاز به بستری طولانیمدت ندارد و دوره نقاهت آن کوتاهتر از جراحی است. برای بیمارانی که کاندید جراحی نیستند یا به شیمیدرمانی سیستمیک پاسخ نمیدهند، کموامبولیزاسیون یک گزینه درمانی مؤثر و امیدبخش محسوب میشود. همچنین، میتواند به عنوان پلی برای رساندن بیمار به مرحلهای که کاندید جراحی یا پیوند کبد شود، استفاده شود. تمامی این مزایا، کموامبولیزاسیون را به یک ابزار ارزشمند در آرسنال درمانی سرطان تبدیل کرده است.
عوارض جانبی و خطرات احتمالی کموامبولیزاسیون
همانند هر روش درمانی پزشکی، کموامبولیزاسیون نیز با وجود مزایای فراوان، میتواند با برخی عوارض جانبی و خطرات احتمالی همراه باشد. آگاهی از این موارد برای بیمار و خانوادهاش ضروری است. شایعترین عوارض جانبی پس از کموامبولیزاسیون شامل سندرم پس از آمبولیزاسیون (Post-embolization Syndrome) است. این سندرم معمولاً 24 تا 48 ساعت پس از عمل رخ میدهد و علائمی شبیه آنفلوآنزا دارد، از جمله تب خفیف، تهوع، استفراغ، درد شکم (ناشی از ایسکمی و التهاب تومور)، و خستگی. این علائم معمولاً با داروهای مسکن و ضد تهوع قابل کنترل هستند و طی چند روز تا یک هفته برطرف میشوند.
خطرات جدیتر، اگرچه نادرتر، شامل آسیب به بافتهای سالم کبد است. اگر ذرات آمبولیک یا داروهای شیمیدرمانی به طور ناخواسته وارد شریانهایی شوند که بافت سالم کبد را تغذیه میکنند، میتوانند باعث آسیب به کبد شوند. این آسیب میتواند منجر به افزایش آنزیمهای کبدی، زردی، و در موارد شدیدتر، نارسایی کبدی شود. با این حال، رادیولوژیستهای مداخلهای با تجربه، با استفاده از تکنیکهای پیشرفته تصویربرداری و دقت بالا، سعی میکنند این خطر را به حداقل برسانند.
عوارض مربوط به محل ورود کاتتر نیز ممکن است رخ دهد، هرچند که معمولاً خفیف هستند. این عوارض شامل خونریزی، کبودی، درد، یا عفونت در محل کشاله ران است. در موارد بسیار نادر، ممکن است به شریان آسیب وارد شود یا لخته خون تشکیل گردد که نیاز به مداخله دارد. به همین دلیل، بیمار پس از عمل کموامبولیزاسیون برای مدتی تحت نظر قرار میگیرد تا از عدم وجود این عوارض اطمینان حاصل شود.
خطرات دیگری که بسیار نادر هستند، شامل واکنشهای آلرژیک به ماده کنتراستزا یا داروهای شیمیدرمانی، یا بروز مشکلات کلیوی (به خصوص در بیماران با سابقه نارسایی کلیه) است. با وجود این خطرات احتمالی، باید توجه داشت که تیم پزشکی قبل از تصمیمگیری برای انجام کموامبولیزاسیون، فواید و خطرات آن را به دقت ارزیابی میکنند و تنها در صورتی که مزایای آن بر خطرات احتمالی پیشی بگیرد، این روش را توصیه میکنند. همکاری بیمار در اطلاعرسانی دقیق سوابق پزشکی و رعایت دستورالعملهای قبل و بعد از عمل، در کاهش این خطرات نقش مهمی دارد.
چه انتظاراتی پس از انجام کموامبولیزاسیون داشته باشیم؟
پس از انجام موفقیتآمیز کموامبولیزاسیون، بیمار برای چند ساعت (معمولاً 4 تا 6 ساعت) در بخش ریکاوری یا بستری تحت نظر قرار میگیرد تا از پایداری علائم حیاتی و عدم بروز خونریزی در محل کاتتر اطمینان حاصل شود. در این مدت، بیمار باید به پشت دراز بکشد و پای مورد عمل را صاف نگه دارد تا از بروز هماتوم (تجمع خون) در محل ورود کاتتر جلوگیری شود. پس از آن، بیمار میتواند با دستورالعملهای لازم برای مراقبت در منزل، ترخیص شود.
در چند روز اول پس از کموامبولیزاسیون، شایعترین انتظار بروز سندرم پس از آمبولیزاسیون است. این سندرم شامل علائمی مانند تب خفیف، تهوع، استفراغ، درد در ناحیه کبد (سمت راست بالای شکم)، و احساس خستگی است. این علائم طبیعی بوده و ناشی از مرگ سلولهای سرطانی و التهاب در کبد هستند. پزشک داروهای مسکن، ضد تهوع، و در صورت نیاز، داروهای تببر را برای مدیریت این علائم تجویز خواهد کرد. معمولاً این علائم ظرف چند روز تا یک هفته برطرف میشوند.
مراقبت از محل ورود کاتتر نیز از اهمیت بالایی برخوردار است. بیمار باید محل برش را تمیز و خشک نگه دارد و از فعالیتهای بدنی سنگین یا بلند کردن اجسام سنگین برای چند روز تا یک هفته خودداری کند. هرگونه تورم شدید، قرمزی، ترشح، یا خونریزی از محل برش باید بلافاصله به پزشک اطلاع داده شود. همچنین، ممکن است پزشک مصرف مایعات کافی را برای کمک به دفع ماده کنتراستزا از بدن توصیه کند.
مهمترین انتظار پس از کموامبولیزاسیون، پیگیری منظم با پزشک معالج است. معمولاً چند هفته پس از عمل، پزشک دستور انجام آزمایشات خون (برای بررسی عملکرد کبد و شمارش سلولهای خونی) و تصویربرداریهای مجدد (مانند سی تی اسکن یا ام آر آی) از کبد را خواهد داد. این تصویربرداریها به ارزیابی پاسخ تومور به درمان کمک میکنند و مشخص میکنند که آیا نیاز به جلسات درمانی بیشتر یا سایر روشهای درمانی مکمل وجود دارد. نتایج این پیگیریها، مسیر درمانی بعدی بیمار را مشخص میکند و بخش جداییناپذیری از روند درمان سرطان با کموامبولیزاسیون است.
نتیجهگیری
کموامبولیزاسیون به عنوان یک روش درمانی نوآورانه و با حداقل تهاجم در رادیولوژی مداخلهای، افقهای جدیدی را در مدیریت برخی از سرطانها، به ویژه سرطان کبد، گشوده است. این تکنیک با ترکیب هوشمندانه شیمیدرمانی موضعی و آمبولیزاسیون عروقی، به طور همزمان سلولهای سرطانی را هدف قرار داده و منبع تغذیه آنها را قطع میکند، که این رویکرد دوگانه منجر به اثربخشی بالاتر و عوارض جانبی کمتر نسبت به شیمیدرمانی سیستمیک میشود. این مزیت، کموامبولیزاسیون را به گزینهای ارزشمند برای بیمارانی که کاندید جراحی نیستند یا به درمانهای دیگر پاسخ نمیدهند، تبدیل کرده است.
همانطور که در این مقاله به تفصیل بررسی شد، از شناخت انواع کموامبولیزاسیون و کاربردهای آن در HCC و متاستازهای کبدی گرفته تا آمادگیهای دقیق قبل از عمل و درک مراحل انجام آن، تمامی جنبهها برای بیماران و خانوادههایشان از اهمیت بالایی برخوردارند. آگاهی از مزایای کاهش عوارض سیستمیک و افزایش کیفیت زندگی، در کنار شناخت عوارض جانبی احتمالی مانند سندرم پس از آمبولیزاسیون، به بیمار کمک میکند تا با دیدی واقعبینانه و با اطمینان خاطر بیشتری وارد فرآیند درمان شود.

در نهایت، موفقیت کموامبولیزاسیون به عوامل متعددی از جمله انتخاب دقیق بیمار، تخصص رادیولوژیست مداخلهای، و پیگیریهای منظم پس از عمل بستگی دارد. این روش نه تنها به کنترل رشد تومور و افزایش بقا کمک میکند، بلکه با بهبود کیفیت زندگی بیماران، امید جدیدی را در مسیر دشوار مبارزه با سرطان فراهم میآورد. کموامبولیزاسیون، بیشک، نمونهای درخشان از پیشرفتهای پزشکی است که با تهاجم کمتر، نتایج درمانی مؤثرتری را به ارمغان میآورد.

دکتر حسین قناعتی، متخصص رادیولوژی با سابقه طولانی در زمینه تصویربرداری پزشکی، یکی از پزشکان برجسته در این حوزه به شمار میآیند. ایشان با بهرهگیری از دانش و تجربهی گسترده خود، خدمات تشخیصی دقیقی را به بیماران ارائه میدهند. دکتر قناعتی علاوه بر فعالیت بالینی، به پژوهش و آموزش در زمینه رادیولوژی نیز مشغول هستند و مقالات و ترجمههای متعددی در این زمینه به چاپ رساندهاند.
سوالات متداول
آیا کموامبولیزاسیون یک نوع شیمیدرمانی است؟
بله، کموامبولیزاسیون نوعی از شیمیدرمانی است، اما نه شیمیدرمانی سیستمیک. این روش یک “شیمیدرمانی منطقهای” است که در آن داروهای شیمیدرمانی به طور مستقیم به تومور تزریق میشوند و نه به کل بدن، که این امر عوارض جانبی را به حداقل میرساند.
چه نوع سرطانهایی با کموامبولیزاسیون قابل درمان هستند؟
کموامبولیزاسیون به طور عمده برای درمان سرطان کبد اولیه (کارسینوم هپاتوسلولار یا HCC) و برخی از متاستازهای کبدی (مانند متاستازهای ناشی از سرطان کولورکتال) مورد استفاده قرار میگیرد، به خصوص زمانی که جراحی امکانپذیر نباشد.
آیا کموامبولیزاسیون دردناک است؟
خیر، فرآیند ورود کاتتر با بیحسی موضعی انجام میشود و بیمار دردی احساس نمیکند. پس از عمل، ممکن است بیمار دچار درد شکم یا علائم سندرم پس از آمبولیزاسیون شود که با داروهای مسکن قابل کنترل است.
چه مدت پس از کموامبولیزاسیون میتوانم به فعالیتهای عادی بازگردم؟
بسیاری از بیماران میتوانند ظرف چند روز پس از کموامبولیزاسیون به فعالیتهای عادی خود بازگردند، اما ممکن است تا یک هفته یا بیشتر علائم سندرم پس از آمبولیزاسیون را تجربه کنند. پزشک دستورالعملهای دقیق را بر اساس وضعیت شما ارائه خواهد داد.
آیا کموامبولیزاسیون سرطان را کاملاً از بین میبرد؟
کموامبولیزاسیون در بسیاری از موارد میتواند به کنترل رشد تومور، کاهش اندازه آن، و افزایش بقای بیمار کمک کند. در برخی موارد نادر، ممکن است تومور به طور کامل از بین برود، اما هدف اصلی آن کنترل بیماری و بهبود کیفیت زندگی است و نه لزوماً درمان قطعی.
آیا کموامبولیزاسیون قابل تکرار است؟
بله، کموامبولیزاسیون میتواند در صورت نیاز و بسته به پاسخ تومور به درمان اولیه و وضعیت عمومی بیمار، تکرار شود. تعداد جلسات و فواصل بین آنها توسط پزشک معالج بر اساس ارزیابیهای منظم و تصویربرداریهای پیگیری تعیین میگردد.